研究概要Research Summary
はじめにIntroduction
幹細胞とは,組織の源となる細胞であり,多分化能とともに幹細胞を再び作る自己複製能を持つ細胞である。がんの悪性化,治療耐性においても,幹細胞特性の獲得・維持機構が重要な役割を果たしている。わたしたちは,正常およびがん組織における幹細胞制御の共通および相違点を見極めることによって,がんを知り,その根治を目指した新たな治療法の開発に寄与したいと考えている。そのため,本研究室では,代謝制御という観点から,幹細胞やがんにおける分化制御・運命決定因子の同定を進めている。具体的には,(1)幹細胞特性に関する異化・同化などの代謝調節制御分子の特定と機能解析,(2)食餌中の栄養素の変動がもたらす全身的栄養代謝変動と幹細胞制御など,複数のプロジェクトを進めている。
Stem cells are defined as cells that have ability to self-renewal and generate mature cells of a particular tissue through differentiation. It is also known that the mechanism for acquiring and maintaining stem cell characteristics, so called “stemness”, plays an important role in the malignant progression and resistance to cancer therapy. The investigation of distinct and parallel roles of stemness in normal and cancer cells will contribute to the development of novel cancer therapy. Our group has been focusing on how the regulation of nutrient-driven metabolism controls cell fate determination of stem cells and cancer cells. For this purpose, we have examined the metabolic regulation from two perspectives: (1) the control of intracellular metabolism by the balance of anabolic and catabolic reactions; and (2) the control of organismal metabolic status by dietary intake of nutrients.
生体における代謝制御の重要性Critical roles of metabolic regulations for life
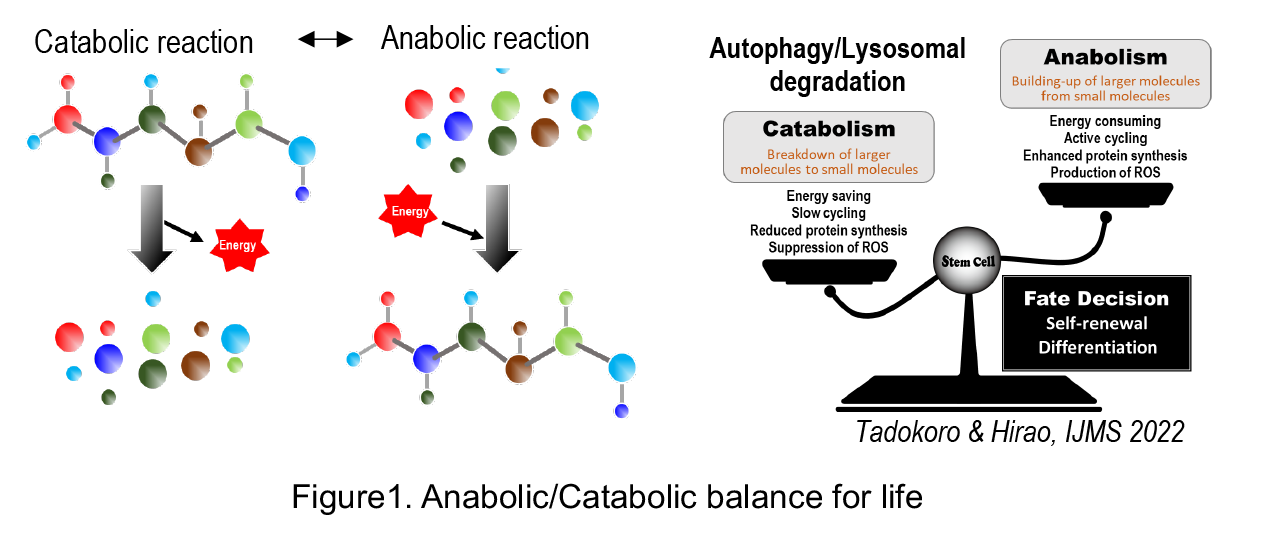
アミノ酸,糖,脂質などの栄養素を感知するシグナルは,エネルギーの産生と消費のバランス調節を介して,細胞の生存や増殖の制御に深く関与する。食餌として取り入れられた栄養素は体内でより小さな分子に変換され,代謝という生命維持に必要な一連の化学反応に利用される。食物や燃料を分解してエネルギーを得る反応を異化反応といい,より小さな分子から大きな分子を合成する反応を同化反応という。同化反応は,異化反応によって生じたエネルギーを消費するため,生命維持には両反応の協調的な制御が重要である(図1)。生体は,恒常性を保つため様々な方策を採用するが,その最も顕著な例が代謝適応である。増殖の活発な細胞では,酸素と糖を利用した効率のよいエネルギー産生経路を使い,それらが枯渇・欠乏した場合は,炭素や窒素源から核酸・アミノ酸・脂質(バイオマス)への流れを司る代謝回路のダイナミックなシフトが作動し生存適応を図る。一方,オンコメタボライトに代表されるように,代謝経路の中間・最終産物でありながら,エピジェネティクス・レドックス・シグナル伝達経路などに直接的に作用し,細胞機能を制御するユニークな代謝物の存在も明らかになりつつある。このような代謝物は,生存・増殖・分化・発生・老化・がん化など様々な生命現象を制御するドライビングフォースとしての役割を果たす。
Nutrients are substances in food that are essential for biological activity in organisms and include carbohydrates, lipids, proteins, vitamins, and minerals. Nutrients are converted by the body into smaller molecules that are utilized for the set of life-sustaining chemical reactions called metabolism. Collectively, reactions that break down food or fuel to obtain energy are called catabolism, whereas the reactions by which larger molecules are synthesized from smaller ones are called anabolism. Anabolic reactions consume the energy produced by catabolic reactions, so that cooperative regulation of both processes is critical for maintaining life (Figure1). The organism employs a variety of measures to maintain homeostasis, the most prominent example being metabolic adaptation. In actively proliferating cells, efficient energy-producing pathways utilizing oxygen and sugar are used, and when these are depleted or absent, dynamic shifts in metabolic circuits that control the flow of carbon and nitrogen sources to nucleic acids, amino acids, and lipids (biomass) are activated to adapt for survival. On the other hand, the existence of unique metabolites, such as oncometabolites, which are intermediate or end products of metabolic pathways but directly act on epigenetics, redox, and signaling pathways to regulate cellular functions, is becoming clear. Such metabolites serve as driving forces that regulate various life phenomena such as survival, proliferation, differentiation, development, aging, and cancer.
(1)幹細胞特性に関する異化・同化などの代謝調節制御分子の特定と機能解析(1) Control of intracellular metabolism by the balance of anabolic and catabolic reactions
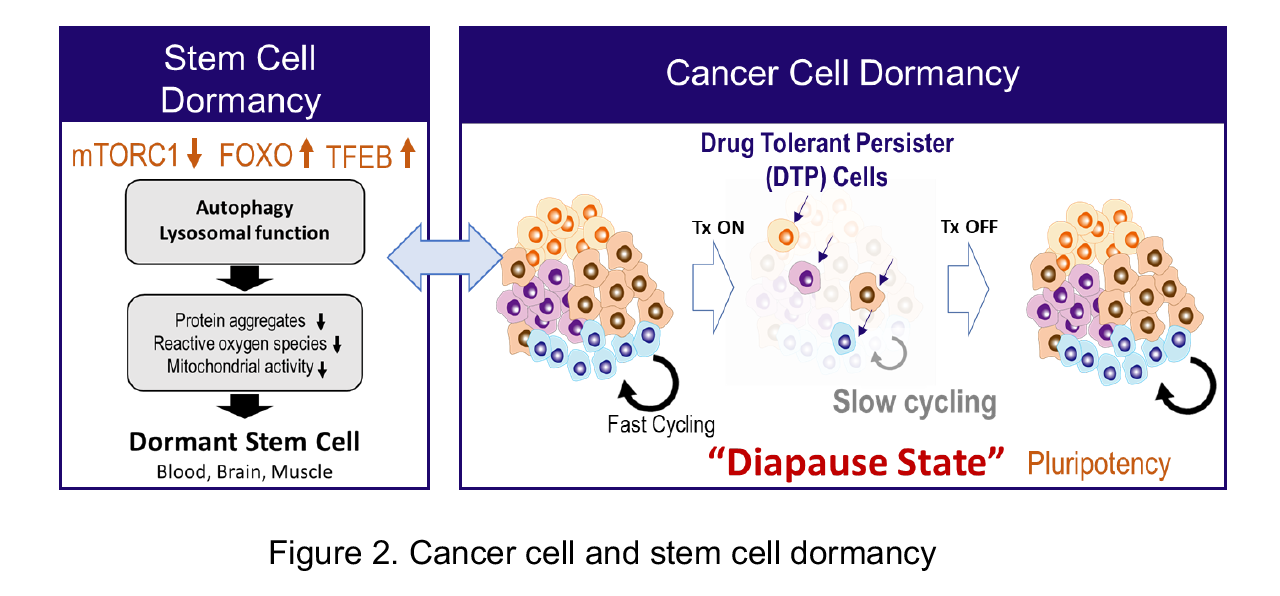
造血幹細胞を含むいくつかの組織幹細胞は,長期間の静止状態または休止状態を維持している。この状態の維持にはオートファジーやリソソーム分解プロセスなどの異化制御が深く関与していることが判明している(図1)。私たちは,造血幹細胞や白血病幹細胞において,栄養飢餓で重要なフォークヘッド転写因子FOXOやオートファジー制御分子ATG5が重要な役割を果たしていることを見出した(Cell Stem Cell 2007, Nature 2010, JCI 2012, PNAS 2014, BBRC 2017, Sci. Rep 2021)(「研究トピックス」へ)。また,脳腫瘍を対象に,mTOR,オートファジー,リソソームがどのような機能を果たしているか,治療薬探索の観点から研究を進め,これらの代謝経路が,がん悪性化因子あるいは治療標的としても重要であることを見出した(JBC 2016, Cancer Sci 2018, 2022)(「研究トピックス」へ)。
最近の研究で,がん治療中の再発の原因となるMinimal Residual Diseaseは,遺伝子変異が背景となるクローン由来とは別に,「休眠状態の誘導機構」の重要性が指摘された。興味深いことに,この休眠状態は,胎生期に生じるDiapauseと極めて類似した制御機構が背景にあることや, MycやmTORのような同化制御分子の抑制によりDiapause状態が惹起されることが知られている(図2)。我々は,異化状態で誘導される分子を同定し,抗がん剤耐性における役割の解明と阻害剤スクリーニングを実施した。現在,ヒット化合物やその類縁体のデータを基に,計算科学を用いた創薬研究の専門家とともに,スーパーコンピューターを用いた分子動態シミュレーションによる最適化を進めており,将来の治療耐性克服の実現に向けてプロジェクトを推進している。
Several tissue stem cells, including hematopoietic stem cells, maintain a prolonged quiescent or quiescent state, which is supported by catabolic regulation, including autophagy and lysosomal degradation processes (Figure 1). We found that the forkhead transcription factor FOXO, which is important in nutrient starvation, and the autophagy regulatory molecule ATG5 play key roles in HSCs and leukemia stem cells (Cell Stem Cell 2007, Nature 2010, JCI 2012, PNAS 2014, BBRC 2017, Sci. Rep 2021) “Research Topics”. As parallel projects, we have investigated roles of mTOR, autophagy, and lysosomes in malignant phenotypes of gliomas from the perspective of therapeutic drug discovery, and found that these metabolic regulators are important as cancer malignant factors or therapeutic targets (JBC 2016, Cancer Sci 2018, 2022) “Research Topics”.
It has recently been proposed that non-mutational drug resistance mechanisms underlie the survival of residual ‘drug tolerant persister’ (DTP) cancer cells, and that these DTPs display transcriptional and functional similarities to cells in “embryonic diapause” (Figure 2). Recently, we have identified a critical metabolic molecule induced by catabolic status, contributing to the induction of diapause state in cancer cells. We have started collaborative research for drug discovery to overcome the drug resistance, by using information technology, such as molecular simulation with a high-performance supercomputer. We believe that delving into how cancer behavior is influenced by nutrient-driven metabolism leads to the development of novel therapeutics useful for treating a variety of cancers.
(2)食餌中の栄養素の変動がもたらす全身的代謝変動と幹細胞制御(2)Diet and stem cell behaviors
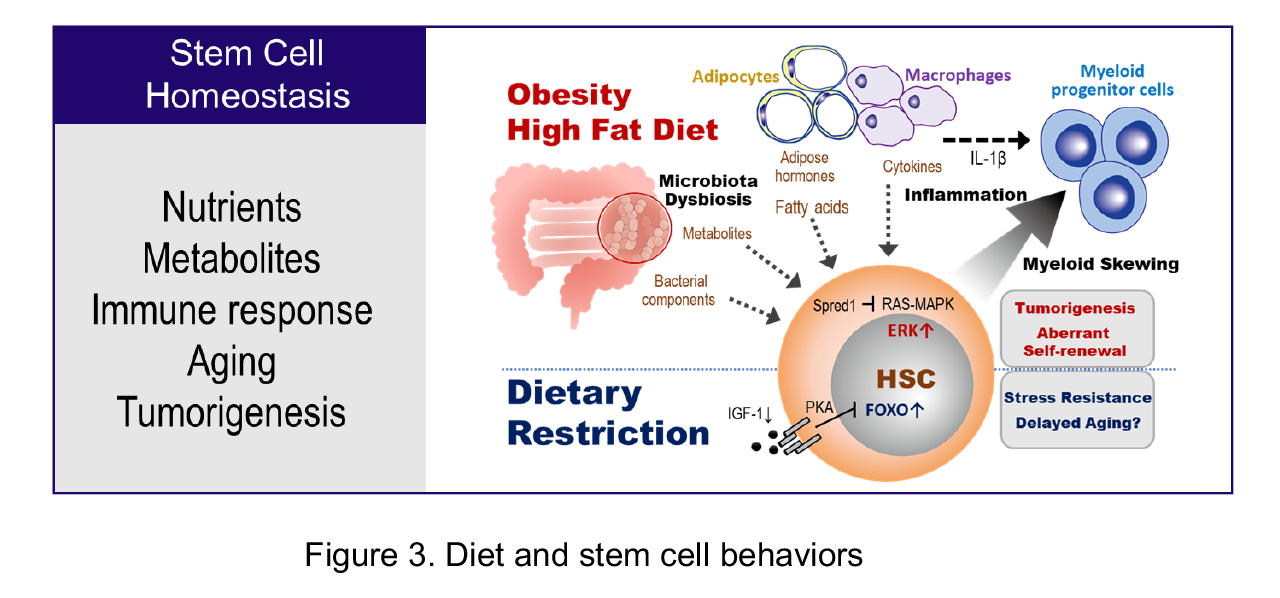
食生活が起因となる全身的栄養環境の変化は,生理的で長期的な要因として組織の恒常性に強く影響を与える。最近の研究により,肥満や高脂肪食などの異常な食餌が,造血幹細胞の運命決定に深く関与していることが知られるようになった(図3)。我々は,高脂肪食の長期摂取が,腸内細菌を介して造血幹細胞・多能性前駆細胞の異常な自己複製を促し,造血器腫瘍の増悪促進に寄与することを見出した (Cell Stem Cell 2018) (「研究トピックス」へ)。現在,そのメカニズムの理解を目的に,アンターゲットメタボロームを実施し,食餌によって有意に変動する代謝物の同定を目指している。代謝物の機能解析を試み,腸内細菌由来代謝物の中に,高脂肪食によって惹起される造血幹細胞や前駆細胞の異常を抑制する化合物が存在することを見出しつつある。現在,更なる候補代謝物の特定や幹細胞制御メカニズムの解析を進めている。さらに,免疫細胞,脂肪細胞などを含め,幹細胞を取り巻く微小環境の役割についても解析を進めている。
Diet is the most common, physiological and long-term stimulus influencing tissue homeostasis. Recent studies have revealed that obesity induced by consumption of a fat-rich diet triggers abnormal hematopoiesis (Figure 3). We previously discovered an important mechanism by which hematopoietic stem cells (HSCs) are protected against the ill effects caused by the dysbiosis (microbial imbalance) of gut microbiota induced by a high fat diet (HFD) (Tadokoro et al., Cell Stem Cell 2018) “Research Topics”. We have been investigating the nature of the "pathological" microenvironments regulating HSCs (HSC niche) created by diet-related metabolites to understand how diet affects hematopoiesis. By multiple metabolomics analyses, we have found that several microbiota derived metabolites which are remarkably down- or up-regulated by HFD, followed by further investigation of functions of the candidate metabolites. We are currently investigating mechanisms of the functional metabolites to prevention or treatment of diseases, which are strongly affected by diet.
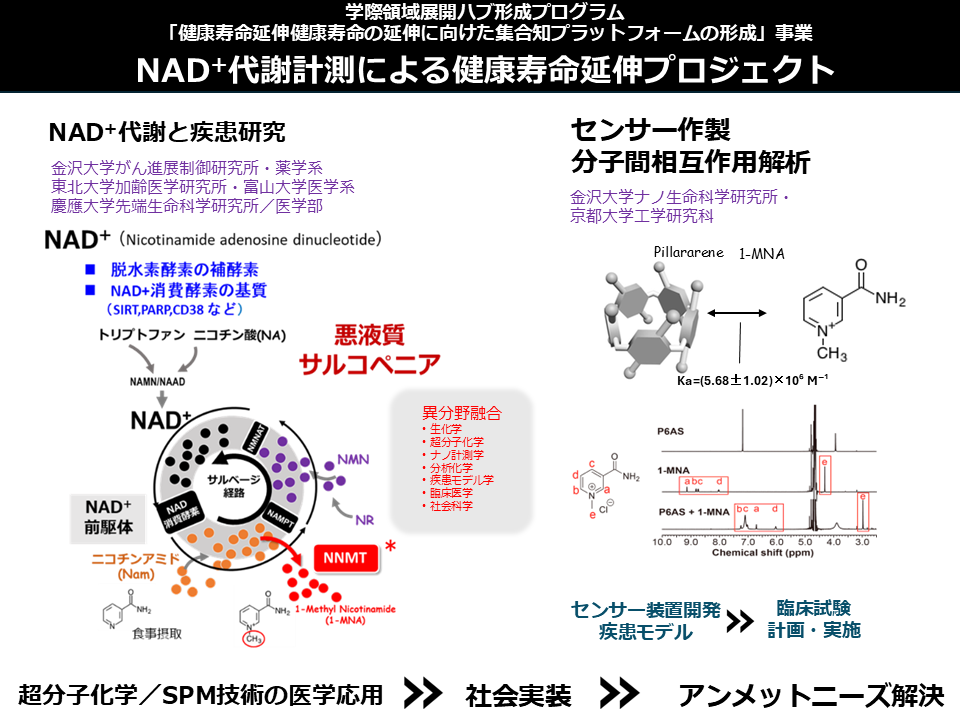
基礎研究に基づいた社会実装への取り組み:NAD+代謝計測による健康寿命延伸
Toward social implementation based on basic research: NAD+metabolism measurement for healthy lifespan extension project
(学際領域展開ハブ形成プログラム「健康寿命延伸健康寿命の延伸に向けた集合知プラットフォームの形成」事業)
(1)NAD+(ニコチンアミド・アデニン・ジヌクレオチド)と健康NAD+(Nicotinamide Adenine Dinucleotide) and Health
NAD+およびそのリン酸化型であるNADP+は、細胞内でのエネルギー移動や酸化還元バランスを促進する電子運搬体として機能する。これらは電子供与体から電子を受け取り、還元型(NADHおよびNADPH)へと変換されることで、エネルギー産生や化学反応の調整など、さまざまな代謝経路に関与する。したがって、NAD+は生命維持に不可欠な分子である。
近年、NAD+が疾患の発症にも深く関与していることが指摘されている。特に、加齢関連疾患や生活習慣病においてNAD+濃度の低下が確認されており、NAD+の減少が老化や疾患の進行を加速させることが動物モデルを用いた研究で示されている。また、NAD+は一日の中で規則的に変動し、このリズムが生体機能と密接に関わることも示唆されている。しかし、現時点ではヒトにおけるNAD+の動態を詳細にモニタリングする手法は確立されておらず、NAD+代謝と健康状態や疾患との関連を正確に評価することが困難である。もしNAD+の状態を正確に計測できる技術が確立されれば、異常を早期に検出し、疾患予防に活用できる新たな医療支援ツールの開発につながると期待される。
NAD+and its phosphorylated form, NADP+, function as electron carriers that facilitate intracellular energy transfer and redox balance. These molecules accept electrons from electron donors and are converted into their reduced forms (NADH and NADPH), thereby regulating various metabolic pathways, including energy production and biochemical reactions. Thus, NAD+is essential for sustaining life.
Recent studies have highlighted the crucial role of NAD+in disease pathogenesis. Specifically, NAD+levels decline in aging-related diseases and metabolic disorders, and animal studies have demonstrated that NAD+depletion accelerates aging and disease progression. Additionally, NAD+exhibits circadian fluctuations, and this rhythmic variation is believed to play a significant role in physiological functions.
However, current methodologies for precisely monitoring NAD+dynamics in humans remain underdeveloped, making it difficult to accurately assess the relationship between NAD+metabolism, health status, and disease. If a system capable of accurately measuring NAD+levels were established, it could enable early detection of abnormalities and lead to the development of novel diagnostic tools for disease prevention.
(2)NAD+代謝計測による「健康状態の見える化」Visualizing Health Status Through NAD+Metabolism Monitoring
私たちは、金沢大学がん進展制御研究所およびナノ生命科学研究所において、医学・生物学・化学・工学・薬学などの専門家が連携し、社会課題の解決に取り組んでいる。その一環として、NAD+に関連する体内代謝物を高感度に検出できる特異的センサーの開発・改良に成功した。このセンサーを用いることで、質量分析などの複雑な装置を使用せずに、生体サンプルを簡便かつ迅速に測定することが可能となる。
現在、医療応用を視野に入れ、さらなる計測技術の開発を進めている。将来的には、NAD+代謝のリアルタイムモニタリング技術を確立し、健康管理や疾患予防に貢献することを目指している。
At the Cancer Research Institute and the Nano Life Science Institute of Kanazawa University, experts from diverse fields, including medicine, biology, chemistry, engineering, and pharmacy, are collaborating to address pressing societal issues. As part of these efforts, we have successfully developed and optimized a highly specific sensor capable of detecting NAD+-related metabolites in the body with high sensitivity. This sensor enables the rapid and straightforward measurement of biological samples without the need for complex instruments such as mass spectrometers.
Currently, we are advancing the development of this measurement technology with a focus on medical applications. Our ultimate goal is to establish a real-time NAD+monitoring system, contributing to improved health management and disease prevention.